При исследовании антагонистической активности в качестве тест – культуры используют условно – патогенные микроорганизмы (кишечная палочка, стафилококк, сальмонелла, протей). Сальмонелла в естественных условиях являются возбудителями септических инфекций, поражений желудочно – кишечного тракта, пневмоний, абортов у животных. Сальмонеллезы поражают телят, ягнят, поросят, птиц, грызунов, жеребят, пушных зверей. (1.) Основной источник заболевания – животные, преимущественно домашние (крупный и мелкий рогатый скот, свиньи и др.) и птицы (куры, утки, гуси и др.). Носителями сальмонелл могут быть и другие представители фауны: мыши, голуби, черепахи, устрицы, тараканы и др. Реже источниками заболевания являются люди – больные и носители.
Заражение происходит фекально-оральным путем. Основной путь передачи инфекции – пищевой. Факторами передачи могут быть не только мясо животных и птиц, инфицированное при жизни животного либо при его обработке, но и яйца. Наиболее восприимчивы к заболеванию люди со сниженным иммунным статусом (в том числе грудные дети) и больные, получающие антибиотики. (3)
Сальмонеллы долго сохраняют жизнеспособность во внешней среде - при комнатной температуре сальмонеллы выживают несколько месяцев. В почве и других объектах внешней среды остаются жизнеспособными от 20 до 120 суток, в трупах до 100 суток, в сухих экскрементах – несколько лет (1), в воде открытых водоемов и питьевой воде живут 11-120 сут., в морской воде – 15-27 сут., в почве – 1-9 мес., в комнатной пыли – 80 -547 сут.(2). Сальмонеллы несколько месяцев сохраняются в соленных и копченных продуктах, в проваренном мясе (1.), в колбасных изделиях – 60-130 сут., в замороженном мясе – 6-13 сут., в яйцах – до 13 мес, в яичном порошке – до 9 мес, на замороженных овощах и фруктах – 0,5 – 2,5 мес. (2).
Целью работы является изучение антагонистической активности пробиотика «Эмпробио» по отношению к Salmonella tiphomurium 144 различными методами.
Материалы и методы. Материалом исследования является пробиотик «Эмпробио»: Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus casei, Streptococcus lactis, Saccharomyces cerevisiae. В качестве тестового микроорганизма использовали эталонный штамм Salmonella tiphomurium 144.
Тестовый микроорганизм использовали в следующих вариантах:
1. суточную культуру Salmonella tiphomurium 144, выращенную на МПА, без разведений;
2. суточную культуру Salmonella tiphomurium 144, выращенную на питательном бульоне, без разведений (18 млрд. клеток в 1 см3 взвеси)
3. 1 млрд. клеток S. tiphomurium 144 в 1 см3.
Жидкий пробиотик «Эмпробио» культивировали при 37º С в течение 3 суток, блоки пробиотика получали на среде МRS, внесением жидких культур глубинным методом (10 млн. кл в 1 см3). Термостатировали при 37º С в течение суток.
Исследования антагонистической активности пробиотика проводили методом агаровых блоков (глубинным и поверхностным) (4). Количество иннокулируемой S. tiphomurium 144 – 1,5 млрд. кл в 1 мл., концентрация штаммов молочнокислых бактерий – по 10 млн. кл.
Поверхностный метод. 0,1 мл взвеси S. tiphomurium 144 равномерно высевали в чашки Петри на поверхность агаровой пластинки со средой МПА. Из агаровой пластинки вырезали симметрично расположенные лунки диаметром 10 мм.
Глубинный метод применяли в двух вариантах. В первом варианте 1 см3 пробиотика смешивали с нагретым и вновь охлажденным до 50°С агаром и затем разливали в чашки Петри. Во втором случае дополнительно 0,5 мл взвеси S. tiphomurium 144 наносили на застывшую агаровую пластинку и стерильным шпателем распределяли по ее поверхности.
Из агаровых пластинок полученных поверхностным и глубинным методами вырезали симметрично расположенные диски диаметром 10 мм, в отверстия вносили 4-6 симметрично расположенных блоков МRS с глубинно выращенным пробиотиком.
После внесения блоков в лунки, часть чашек помещали на экспозицию при 5 °С на 5 часов. Вторую часть исследуемых чашек Петри сразу после посева помещали в термостат. Все чашки термостатировали при температуре 37°С 18-24 часа, до появления на поверхности среды сплошного слоя колоний, на следующие сутки измеряли диаметр зоны задержки роста S. tiphomurium 144 в мм.
Результаты и обсуждение. Результаты исследований показывают высокую антагонистическую активность пробиотичка «Эмпробио» по отношению к S. tiphomurium 144. При глубинном посеве, зоны задержки роста тест - штамма сальмонеллы были больше, чем при поверхностном посеве, не зависимо вариантов экспозиции чашек Петри с посевами (Р<0,01) При поверхностном методе посева отмечена наибольшая зона задержки роста тест - штамма S. typhimurium 144 без разведения, при глубинном – 18 млрд. взвеси клеток тест - штамма (табл. 1 и табл.2).
Таблица 1 Антагонистическая активность пробиотика «Эмпробио» поверхностным методом
|
Варианты экспозиции |
Зона задержки роста тест - культуры Salmonella typhimurium 144, мм |
||
|
Культура без разведения |
18 млрд. клеток в 1 см3 взвеси |
1 млрдн. клеток в 1 см3 взвеси |
|
|
Без экспозиции при 5 °С |
18±0,6 |
16,5±0,4 |
17±0,6 |
|
Экспозиция при 5 °С в течении 5 часов |
25±0,5 |
24±0,2 |
22±0,5 |
Таблица 2 Антагонистическая активность пробиотика «Эмпробио» глубинным методом
|
Варианты экспозиции |
Зона задержки роста тест - культуры Salmonella typhimurium144, мм |
||
|
Культура без разведения |
18 млрд. клеток в 1 см3 взвеси |
1 млрдн. клеток в 1 см3 взвеси |
|
|
Без экспозиции при 5 °С |
23±0,5 |
24±0,3 |
22±0,7 |
|
Экспозиция при 5 °С в течении 5 часов |
26±0,6 |
27±0,6 |
26±0,4 |
|
Дополнит внесение без экспозиции при 5 °С |
20±0,4 |
22±0,3 |
19,5±0,3 |
|
Дополнит внесение с экспозицией при 5 °С |
22±0,4 |
25±0,6 |
25,5±0,2 |
В вариантах с использованием предварительной экспозицией при 5°С в течении 5 часов зоны подавления были больше как при поверхностном посеве (табл. 1), так и при глубинном (табл.2). Экспозиция при низких положительных температурах позволяет метаболитам молочнокислых бактерий диффундировать в толщу среды и тем самым задерживает рост условно-патогенного микроорганизма (рис. 1).
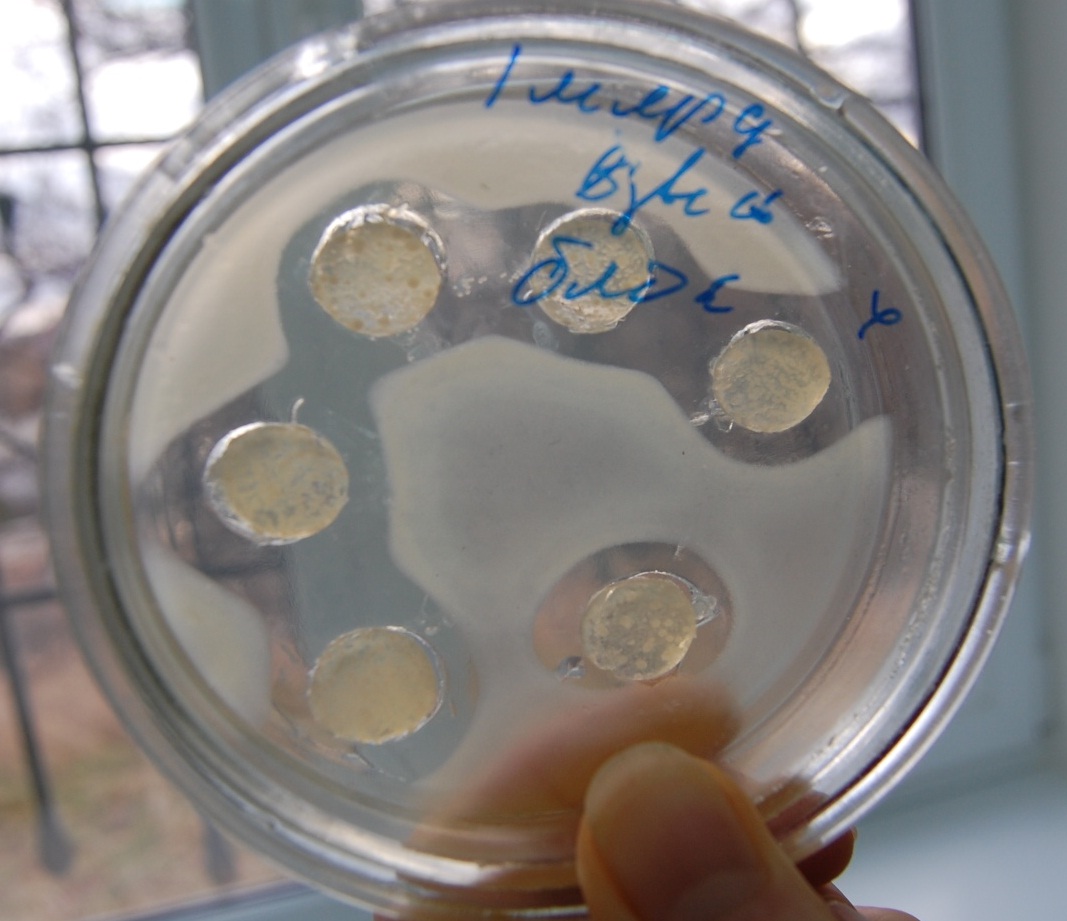
Рис. 1. Антагонистическая активность пробиотика «Эмпробио» по отношению к S. tiphomurium144.
Дополнительное внесение на глубинный посев 0,5 мм жидкой культуры пробиотика так же оказало положительное влияние на антагонистическую активность исследуемого пробиотика, но в меньшей степени, чем при глубинном посеве.
Полученные данные свидетельствуют о том, что наибольшее влияние «Эмпробио» оказывает на сальмонеллу при ее глубинном посеве, с предварительной постановкой чашек в холодильник на 5 часов для преддиффузии.
Выводы.
- Пробиотик «Эмпробио» обладает антагонистической активностью по отношению к Salmonella tiphomurium 144.
- При исследовании антагонистической активности штаммов микроорганизмов с разными питательными потребностями метод агаровых блоков с глубинным посевом и экспозицией при низких положительных температурах является предпочтительнее, чем методы с поверхностным внесением и без экспозиции в холоде.
Литература.
1. Ветеринарная микробиология/ П.А. Емельяненко, Г.В. Дунаев, Д.Г Кудлай и др. Учебники и учебные пособия для высш. с/х учебн. завед. - 304 с.
2. Воробьев А. А. Медицинская и санитарная микробиология: Учебное пособие для высших мед. учебн. завед. / Воробьев А. А., Кривошеин Ю.С., Широбрков В.П. – М.: Издательский центр «Академия», 2003. – 464 с.
3. О.К. Поздеев, Медицинская микробиология. Под ред. Акад. РАМН В.И. Покровского, Учебник для ВУЗов, Москва, ГЭОТАР, 2001, 767 стр.
4. Зенова Г.М. Практикум по биологии почв: практикум по биологии почв / Зенова Г.М., Степанов А.Л., Лихачев А.А., Манучарова Н.А. – М.: Изд-во МГУ, 2002. – 120 с.
Отзывы:
